
2月15日,加拿大健康科学院院士、温州医科大学学术副校长、老年研究院院长、瓯江实验室主任宋伟宏院士团队在国际期刊FASEB Joural发表题为“Unveiling the Role of KLF9-mediated IFITM3 Regulation in Amyloidogenesis”的研究论文,发现Krüppel-like factor 9(KLF9)通过调控神经元内干扰素诱导跨膜蛋白3(Interferon Induced Transmembrane Protein 3,IFITM3)参与AD的发病机制。本研究是宋伟宏院士团队继阐明脑血管内皮细胞IFITM3在AD发病新机制(Alzheimer’s & Dementia,2025)后的又一项聚焦于神经元IFITM3调控参与AD发病机制的突破性研究成果,为靶向KLF9和IFITM3的AD药物开发和治疗提供了新思路。

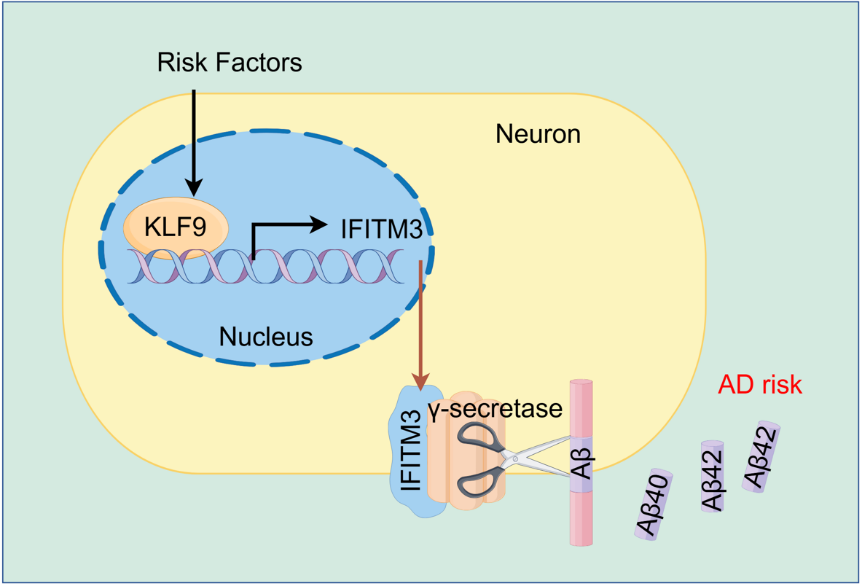
AD是最常见的导致老年痴呆的神经退行性疾病,其核心病理特征为β-淀粉样蛋白(Amyloid β protein, Aβ)的异常沉积,这一特征已被确立为AD诊断的最重要生物学标志。Aβ的生成主要依赖于β-分泌酶1(Beta-site APP-cleaving enzyme 1,BACE1)和γ-分泌酶对淀粉样前体蛋白(Amyloid precursor protein, APP)的酶切作用。近年来,干扰素诱导的跨膜蛋白3(Interferon-induced transmembrane protein 3, IFITM3)在Aβ生成过程中的调控作用受到广泛关注。研究表明,IFITM3通过调节γ-分泌酶活性促进Aβ的产生。然而,IFITM3的转录调控机制尚不明确。
IFITM3基因位于人类11号染色体的11p15.5区域,包含两个外显子,其编码区全长611 bp,编码133个氨基酸。本研究证实,IFITM3基因的-1000至+47启动子区域具有完整的启动子活性,其中-300至-200区间含有重要的调控元件,转录因子KLF9的结合位点即位于该区域。进一步实验表明,KLF9能够特异性结合IFITM3启动子基序,调控其启动子活性,并调节IFITM3的转录及蛋白表达水平。更为重要的是,体内实验结果表明,神经元特异性过表达KLF9不仅显著上调IFITM3的表达水平,同时导致Aβ40和Aβ42的生成显著增加。这一发现提示,转录因子KLF9可能通过IFITM3依赖性或(和)非依赖性途径参与AD的发生与发展过程。本研究首次揭示了KLF9作为AD病理风险因子的重要作用,为深入解析Aβ生成的分子调控机制提供了新的理论依据,同时也为AD的靶向治疗策略提供了潜在的干预靶点。
我校宋伟宏院士是本研究的通讯作者,老年研究院副院长吴伊丽教授是本研究的共同通讯作者。宋伟宏院士团队的博士研究生冯艺佳、硕士研究生周倩以及博士研究生胡波浪完成主要研究工作,为文章的共同第一作者。
扫一扫在手机打开当前页