
近年来,研究发现阿尔茨海默病(AD)的发生发展与糖脂代谢异常密切相关。研究提示,用于治疗2型糖尿病和肥胖症的胰高血糖素样肽-1受体激动剂 (GLP-1RAs),不仅能改善外周糖脂代谢,还能通过血脑屏障,发挥神经保护作用,可能成为防治AD的新策略,但其对AD的作用及具体分子机制不清。
5月20日,温州医科大学学术副校长、老年研究院院长,加拿大健康科学院院士,瓯江实验室主任宋伟宏院士和南京大学医学院附属鼓楼医院张韵研究员团队在Nature Aging《自然-衰老》在线发表题为“Activation of AMPK by GLP-1R agonists mitigates Alzheimer-related phenotypes in transgenic mice”的研究论文,该研究发现GLP-1RA通过激活细胞能量代谢重要通路AMPK,显著降低AD核心病理特征,并有效改善认知功能障碍。这一突破性发现不仅阐明了GLP-1RA神经保护作用的关键分子机制,亦为开发基于代谢调控的AD靶向治疗策略提供了新方向。

胰高糖素样肽-1(GLP-1)是由小肠L细胞分泌的一种葡萄糖依赖性肠促胰素,对维持人体血糖浓度至关重要。 GLP-1促进胰岛素合成和分泌、抑制胰高糖素分泌从而降低血糖。 GLP-1亦可以抑制食欲并减缓胃排空。GLP-1受体激动剂(GLP-1RAs)已用于治疗2型糖尿病和肥胖症。有研究提示GLP-1RAs具有潜在的神经保护作用。然而,GLP-1RAs是否能够用于防治阿尔茨海默病是亟待解答的问题。
GLP-1受体在中枢神经系统中呈现广泛分布特征,包括在海马与前额叶皮层等认知功能相关脑区具有显著表达。然而,其调节认知功能的具体机制尚不明晰。该研究发现AD患者或模型小鼠外周血中的GLP-1水平显著降低,且表达水平与PET-MR检测显示的脑内Aβ斑块沉积量呈现显著负相关性(图1)。这一发现提示GLP-1信号通路功能障碍可能在AD的病理进程中发挥重要作用。
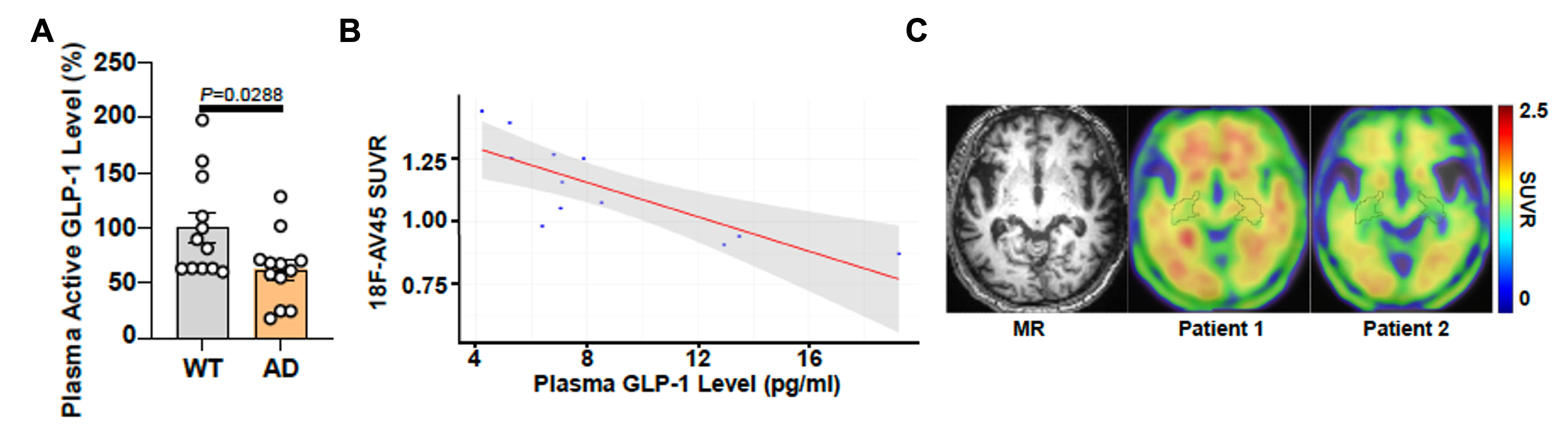
图1. AD病患与模型小鼠外周血中的GLP-1水平显著降低,且与脑内Aβ斑块沉积量呈现负相关
研究人员进一步使用GLP-1受体激动剂Exendin-4(艾塞那肽)或 Tirzepatide(替尔泊肽)增强GLP-1信号通路后,发现其可上调钙调蛋白激酶激酶2(CaMKK2),从而激活AMPK信号通路。作为细胞能量代谢的关键调控因子, AMPK在维持细胞能量稳态中具有核心作用。激活后的AMPK通过两种途径调控Aβ代谢:1)抑制NF-κB信号通路,降低β-分泌酶(BACE1)的转录调控,继而减少BACE1酶的生成及其介导的淀粉样前体蛋白(APP)的剪切和Aβ的产生(图2);2)显著增强小胶质细胞的吞噬功能,促进Aβ清除(图3)。
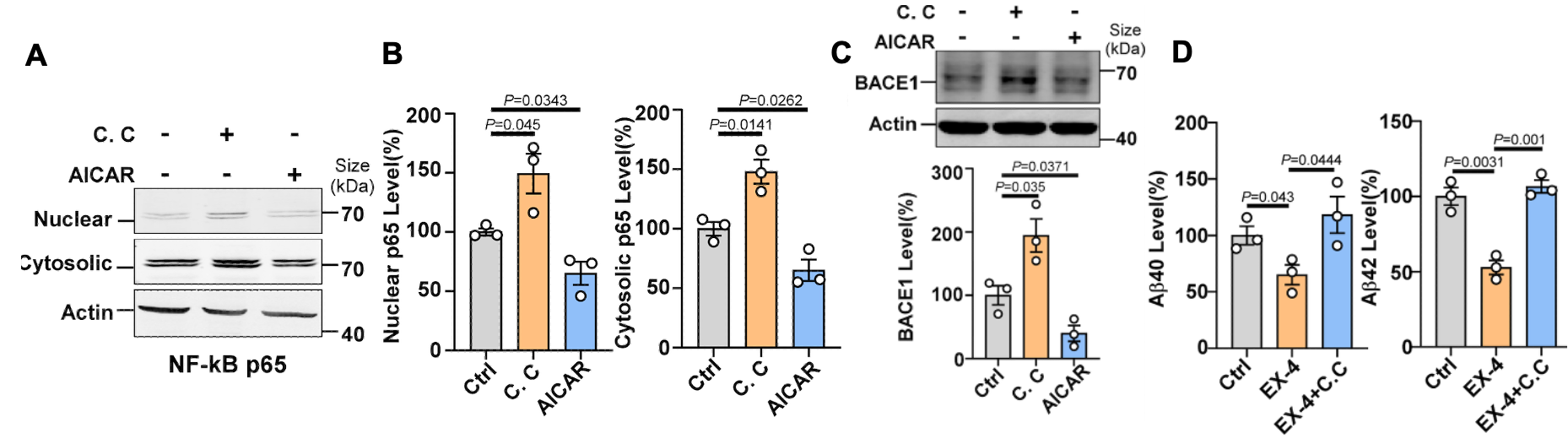
图2. GLP-1RAs通过抑制NF-κB信号通路,降低BACE1转录并减少BACE1介导的Aβ生成
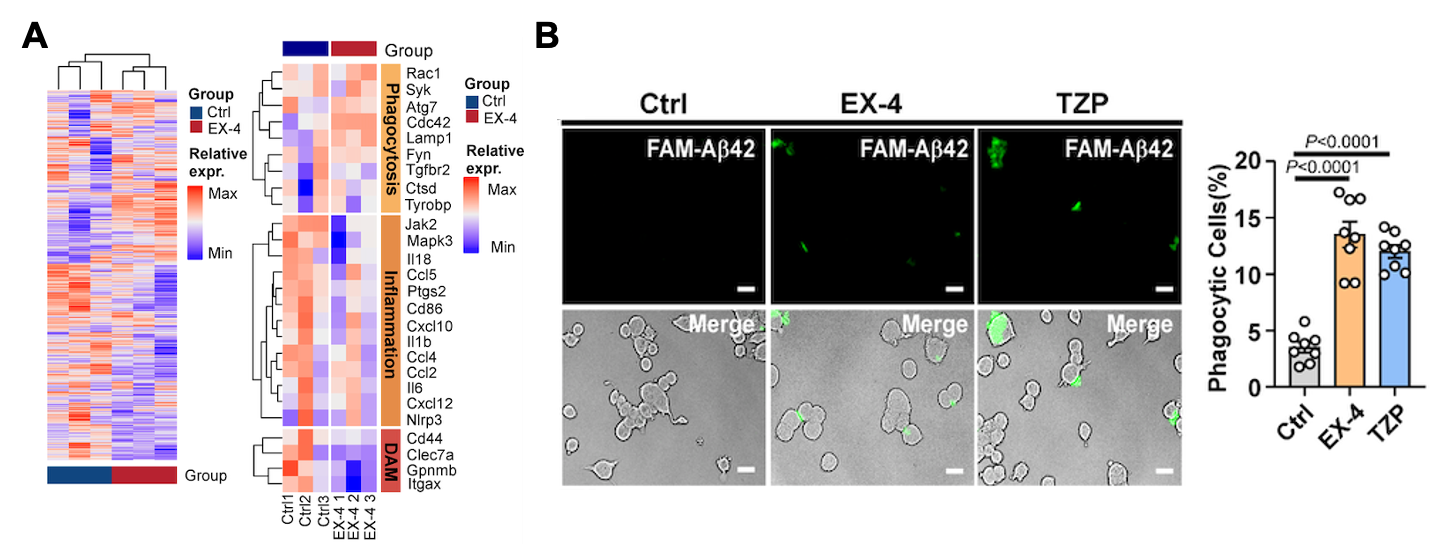
图3. GLP-1RAs抑制小胶质细胞炎症因子表达并促进其对Aβ的吞噬作用
同时,GLP-1RAs还能通过提升星形胶质细胞和神经元中的AMPK活性,改善其能量代谢状态,并增强星形胶质细胞与神经元之间的代谢协同作用。这些多靶点效应最终显著减少了AD模型小鼠脑内的Aβ生成和斑块沉积,有效改善了其认知功能(图4)。
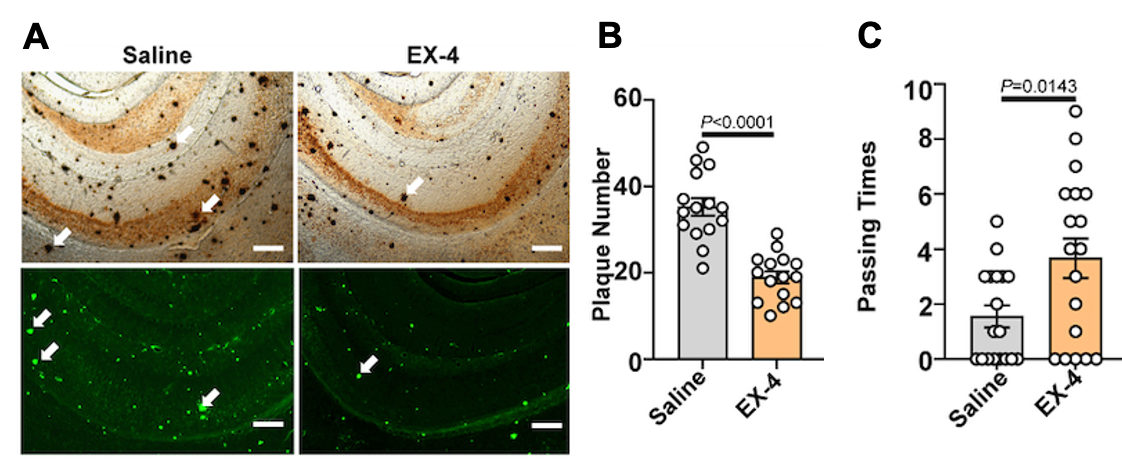
图4. GLP-1RAs显著抑制AD小鼠脑内Aβ斑块形成并改善AD小鼠的认知损伤
这些突破性发现不仅从分子机制层面证实了GLP-1RA通过调节糖脂代谢通路改善神经退行性病变的作用靶点,进一步构建了代谢干预与神经保护协同调控的理论体系 (图5)。研究结果为GLP-1RAs在阿尔茨海默病防治领域的临床应用转化提供了关键实验证据,将有力推动相关临床实验的开展和适应症拓展。
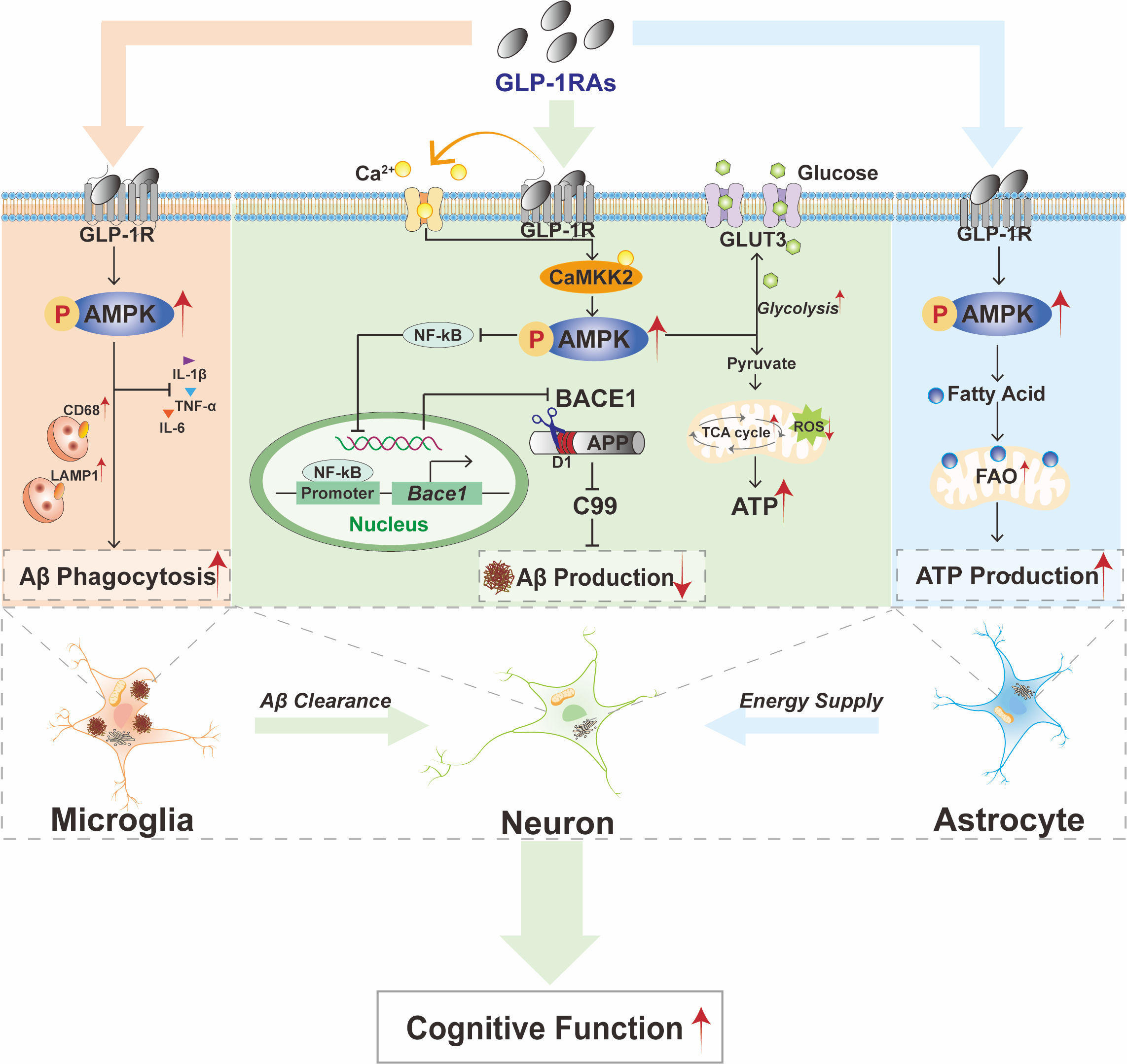
图5. GLP-1RAs通过调节能量代谢缓解AD病理特征与认知损伤
温州医科大学学术副校长、老年研究院院长,加拿大健康科学院院士,瓯江实验室主任宋伟宏院士和南京鼓楼医院张韵研究员为本研究的通讯作者,张韵研究员和宋伟宏院士团队的博士研究生陈华秋、冯艺佳为文章的共同第一作者。
扫一扫在手机打开当前页