
11月2日,我校池在龙教授团队在美国科学院院刊PNAS在线发表题为“Anti-angiogenic properties of microRNA-29a in preclinical ocular models”的研究论文,阐述微小核酸药物中的miR-29家族在眼部血管新生过程中的调控作用及相关影响效应,揭示了眼部新生血管形成的表观遗传调控新机制,为临床治疗此类疾病提供更多选择。

新生血管形成是增殖性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)、湿性年龄相关性黄斑变性(wet age-related macular degeneration,wAMD)、早产儿视网膜病变(retinopathy of prematurity,ROP)以及各种原因引起的角膜新生血管等多种眼部疾病的共同病理特征,也是导致视力损伤和不可逆盲的重要因素。当前临床以对症治疗为主,但存在部分患者对药无应答、视网膜及周边神经元受损等局限性。深入探索眼部新生血管形成的复杂调控机制,开发新的治疗靶点,对减缓新生血管性眼病的进展、提高患者视功能并改善生活质量具有重要意义。
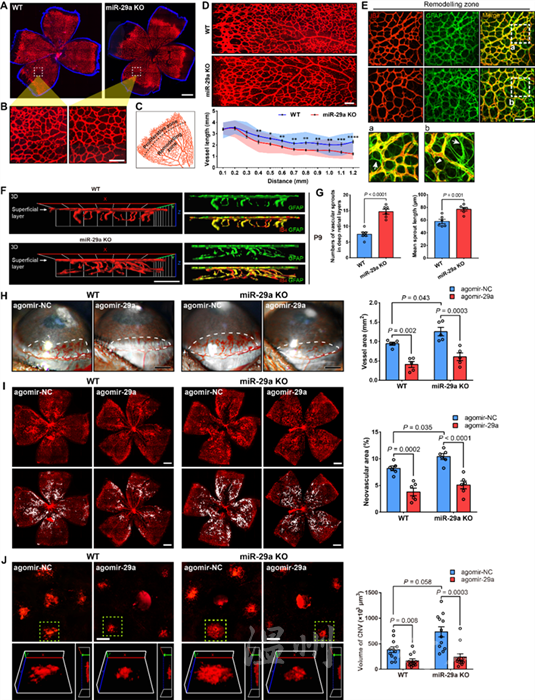
图1 miR-29a影响视网膜血管重塑和眼部新生血管形成
池在龙教授研究团队利用三种不同的眼部新生血管临床前模型以及miR-29a敲除小鼠模型,同时结合人视网膜微血管内皮细胞等所开展的体内外研究,发现miR-29a可通过胶原蛋白COL7A1、溶质运载蛋白SLC43A2和血小板衍生生长因子PDGFC等多个靶基因实现抑制眼部血管新生形成的功能作用及表观调控机制。这项研究阐明了miR-29a在维持血管稳态中的重要作用,也是继VEGF, PDGF信号通路、细胞外基质(ECM)等病理性新生血管形成因素的又一个重要补充,或可成为新生血管性眼病的潜在治疗靶点。
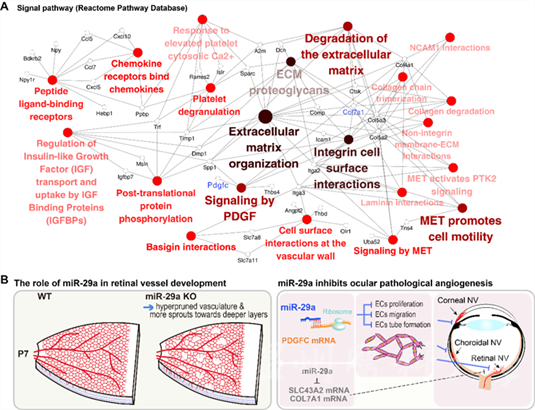
图2 miR-29a调控眼部血管发育和病理性新生血管的表观调控机制示意图
该研究由温州医科大学附属眼视光医院、眼视光学和视觉科学国家重点实验室池在龙研究员指导完成,温州医科大学附属眼视光医院助理研究员彭德伟和2016级硕士研究生蓝春林为本文的共同第一作者。该研究得到国家自然科学基金、浙江省自然科学基金重点项目等基金的资助。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2204795119
扫一扫在手机打开当前页