
脓毒血症(Sepsis)是由于机体感染所引发的全身急性炎症反应综合征,是各种严重创伤、烧伤、缺氧、再灌注损伤及外科大手术后常见的并发症,是重症监护室患者的首位死亡原因。肺脏是脓毒症时最易累及的靶器官,急性肺损伤(Acute lung injury, ALI)是脓毒症过程中最早出现的并发症,发生率和死亡率极高。在脓毒血症发生过程中,细菌内毒素脂多糖(LPS)通过直接结合免疫细胞表面的模式识别受体(髓样分化蛋白2和Toll样受体4,MD2/TLR4)而激活TLR4炎症信号通路,进而大量释放炎症细胞因子,形成炎症因子“风暴”,损伤组织和器官。由于脓毒血症的发生急促而猛烈,涉及大量的炎症信号和细胞因子,临床上目前尚无有效治疗上述疾病的手段和药物。因此,寻找和发现新的脓毒症和急性肺损伤的有效靶标和治疗药物显得尤为迫切。
天然产物是治疗重大疾病的药物或重要先导化合物的主要源泉之一。为了寻找和发现治疗脓毒血症和急性肺损伤的新药,校化学生物学研究中心通过大量文献调研和高通量筛选技术,先后选取了肉桂酸、查尔酮等多种具有一定抗炎活性的天然结构为先导化合物。经过进一步的结构设计、化学修饰、有机合成和生物活性筛选,科研团队获得多个系列的100多个新型肉桂酸、查尔酮及含吲哚杂环的结构类似物。其中,肉桂酸结构类似物2i和查尔酮类似物20均表现出优秀的抗炎活性。在机制上,科研团队通过大量生物化学实验发现2i和20可直接靶向并结合脓毒血症发生过程中最上游的蛋白之一MD2,有效地拮抗细菌内毒素脂多糖(LPS)与MD2的结合,属于新颖的MD2小分子抑制剂。进一步研究发现,化合物2i和20主要通过与MD2的Arg90及Tyr102氨基酸残基形成氢键作用结合到MD2蛋白的疏水性口袋,从而阻断LPS与MD2的相互结合而发挥抗炎效果。体内外实验均表明,两个化合物可有效抑制LPS刺激的巨噬细胞炎症因子的释放及炎症信号通路的激活,缓解LPS诱导的小鼠脓毒症及急性肺损伤。这两项工作为靶向MD2的抗脓毒血症新药开发提供新的先导化合物和候选药物,相关研究结果分别发表在《Journal of Medicinal Chemistry》学术杂志上。
吲哚美辛是经典的COX抑制剂类非甾体抗炎药,在临床使用中,通常会引起皮疹、头痛、恶心和胃肠道反应等多种毒副作用。该中心以吲哚美辛等抗炎药物为先导化合物,优化设计并合成了40余种吲哚-2-甲酰胺类似物。通过对该系列类似物的系统研究,课题组不仅初步阐明了该类化合物抗炎的构效关系,而且发现了多个可有效治疗脓毒症的新颖的杂环类小分子候选药物,其中化合物14f和14g在体外可以剂量依赖性地抑制炎症因子IL-6和TNF-α的表达来缓解炎症反应,在体内能缓解脓毒症及其肺组织损伤,且体内毒性实验证实两个化合物对小鼠的心脏、肝脏和胃等器官不会产生直接损伤作用,是一类潜在的高效、低毒的脓毒症治疗候选药物分子。该研究的相关成果也被《Journal of Medicinal Chemistry》接收发表。
《Journal of Medicinal Chemistry》由美国化学会创办,是药物化学专业领域最权威和最老牌的杂志。化学生物学研究中心长期从事炎症和肿瘤药物化学与生物学机制研究,截止目前,中心已经在《Journal of Medicinal Chemistry》以温医为第一单位和通讯单位发表论文五篇。在药物化学领域形成一定的影响力,获得同行专家的认可,中心主任梁广研究员获得2015年中国药学会青年药物化学奖。受两省一市药学会药物化学专业委员会批准委托,药学院还将于今年10月份承办2016年长三角药物化学研讨会。
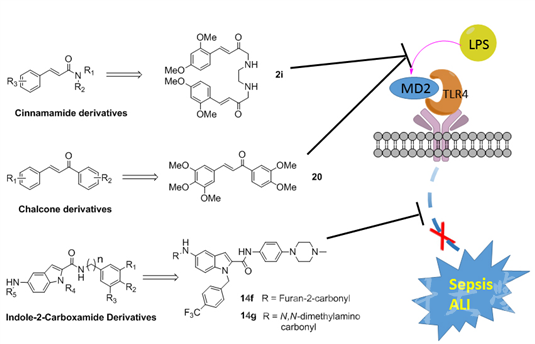
FGF21化学生物学中心发现的三类抗炎活性化合物及其缓解脓毒血症的分子机制示意图
扫一扫在手机打开当前页