
3月1日,加拿大健康科学院院士、温州医科大学学术副校长、老年研究院院长、瓯江实验室主任宋伟宏院士团队在国际权威期刊Signal Transduction and Targeted Therapy(IF=39.3)发表了题为“Contactin-associated protein-like 2 (CNTNAP2) mutations impair the essential α-secretase cleavages, leading to autism-like phenotypes”的研究论文,发现与阿尔茨海默病(Alzheimer’s disease, AD)相关的α-分泌酶(ADAM10/17)是剪切CNTNAP2蛋白以实现其生理功能所必需的蛋白酶; 而CNTNAP2基因突变影响其α-分泌酶剪切是孤独症致病的重要机制之一。该研究成果提示CNTNAP2酶切及其产物为孤独症药物的新靶点。

孤独症,又称自闭症或孤独性障碍,是一种最常见的儿童脑发育障碍性疾病。CNTNAP2是孤独症的关键致病基因之一,部分孤独症患者被检测到携带CNTNAP2基因变异。CNTNAP2蛋白是一种典型的多结构域Ⅰ型跨膜蛋白,由1331个氨基酸组成。CNTNAP2属于Neurexin家族的突触蛋白,发挥细胞粘附分子的重要作用。CNTNAP2基因敲除小鼠呈现出典型的孤独症样行为,包括社会活动减少和重复刻板行为,同时伴随着神经发育异常。宋伟宏院士团队先前报道CNTNAP2可被阿尔茨海默病相关的γ-分泌酶剪切,其生成的CNTNAP2细胞内结构蛋白(CNTNAP2 intracellular domain,CICD)可改善孤独症样表型。然而,对于CNTNAP2的复杂代谢过程和其异常导致孤独症的致病机理尚不完全明确。

CNTNAP2蛋白质的基本结构及突变示意图
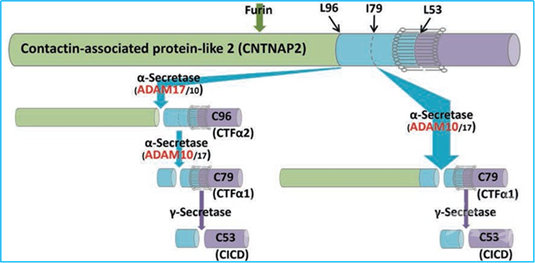
在最新的研究中,宋伟宏院士团队发现在γ-分泌酶剪切之前需要其他蛋白酶的处理。CNTNAP2通过Furin和α-分泌酶(ADAM10/17)对其进行蛋白酶解。其中ADAM10剪切CNTNAP2的产物C79是后续γ-分泌酶剪切形成CICD并实现其生理功能的关键前提。此研究进一步发现孤独症致病性CNTNAP2-I1254T突变的发生明显抑制了α-分泌酶对CNTNAP2的剪切效率,致使C79生成水平显著降低,导致CNTNAP2-I1254T突变基因敲入小鼠呈现出孤独症样行为表型。而提高C79表达水平明显改善CNTNAP2-I1254T突变基因敲入小鼠和CNTNAP2基因敲除小鼠的孤独症样行为表型。这项研究证明了α-分泌酶对CNTNAP2蛋白代谢的必要性以及其异常对孤独症的致病机制至关重要,表明α-分泌酶剪切产物C79可能对孤独症障碍的治疗具有重要疗效。
我校宋伟宏院士与中南大学生命科学学院李家大教授、首都医科大学宣武医院张韵副教授是本项成果的共同通讯作者。宋伟宏院士团队的张晴博士、博士后邢蒙恩以及硕士生鲍正凯完成主要实验工作,为文章的共同第一作者。
扫一扫在手机打开当前页