
日前,以药学院黄志锋博士领衔的结构生物学课题组在国际上率先解析成纤维细胞生长因子受体4(FGFR4)激酶区域的结构,并获得一种可以特异性抑制导致横纹肌肿瘤FGFR4功能突变体的新型抑制剂FIIN2。相关论文《1型非可逆抑制剂对FGFRs功能突变体的DFG-Out新型抑制模型》、《能克服第1代抑制剂对FGFR产生耐受的新型共价抑制剂的开发》,以第一作者和并列第一作者分别发表在美国化学学会化学生物学杂志(ACS Chemical Biology ,IF=5.38)和美国国家科学院院刊(PNAS ,IF=9.802) 。
FGFR4是FGFR家族的第四个也是迄今为止发现的最后一个家族成员,在调控细胞增殖和代谢过程中发挥着重要的作用,而近年来有关FGFR4激酶区域的突变会导致诸如横纹肌肿瘤、幼儿骨骼发育异常的报道更使得FGFR4成为科学研究的热点,但由于一直缺乏对FGFR4结构的清晰认识,有关FGFR4信号传导的特征以及针对疾病相关性异常突变的抑制剂开发进展相当缓慢。药学院结构生物学课题组在学校首位“国家外专千人”、纽约大学医学中心国际生长因子权威教授莫萨·穆罕穆迪持续4年的指导下,在国际上率先成功解析并报道了FGFR四个受体亚单元包括FGFR4在内的三个受体激酶区域的结构(FGFR2,Cell Reports, 2013;FGFR3 ,Structure, 2013;FGFR4, PNAS, ACS Chemical Biology,2014),系列研究为阐述FGFR激酶作用机制提供了清晰的结构蓝图,对更多针对FGFR突变体的抑制剂创新药物设计与开发奠定了坚实的理论基础。
论文链接:
http://pubs.acs.org/doi/abs/10.1021/cb500674s
http://www.pnas.org/content/111/45/E4869.long
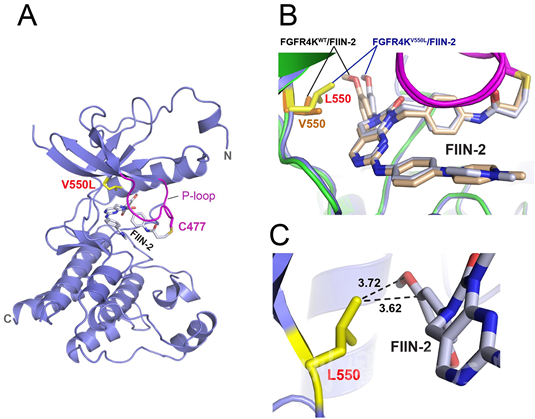
(A)FGFR4激酶与FIIN2复合物晶体结构;(B) FIIN2克服抑制剂耐受的结构机制;(C)FGFR4 V550L突变与FIIN2的空间距离分析
扫一扫在手机打开当前页