
日前,检生学院吕建新教授与丁焕根教授合作,在 “ 内分泌学与代谢 ”子行业的优秀级杂志《Free Radical Biology and Medicine》( 影响因子:6.020,二区期刊 ) 发表了题为 “ Electron transfer kinetics of the mitochondrial outer membrane protein mitoNEET.” 的研究论文,揭示了人线粒体外膜蛋白mitoNEET结合的[2Fe-2S]铁硫簇在有氧和无氧条件下的动力学, mitoNEET蛋白结合的[2Fe-2S]铁硫簇从还原型黄素单核苷酸(Reduced Flavin mononucleotide,FMNH2 )中获得电子,形成还原态的[2Fe-2S]铁硫簇,然后进一步作为电子供体将电子以不同的速率传递给不同的电子受体如氧气、ubiquinone等这样一条电子传递链的模型。
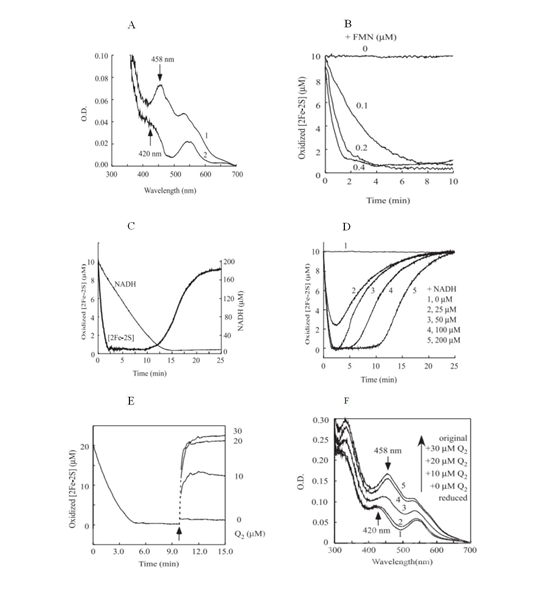
MitoNEET蛋白是人体内的一种线粒体外膜蛋白,有文献报道mitoNEET蛋白在线粒体中能量代谢、氧化损伤的修复、维持线粒体内的稳态等方面发挥着重要的作用,但是mitoNEET蛋白在人体内的具体功能仍不明了。该研究发现在无氧条件下黄素单核苷酸(Flavin mononucleotide,FMN)会被等量的还原型辅酶I(Reduced nicotinamide adenine dinucleotide,NADH)以及黄素单核苷酸还原酶(Flavin reductase)还原,而在无氧条件下mitoNEET蛋白结合的[2Fe-2S]铁硫簇能被等量的FMNH2还原,而还原态的mitoNEET蛋白 [2Fe-2S]铁硫簇暴露在空气中时,能被空气中的氧气以6.0 M ?1 .s ?1的速率常数缓慢的氧化;相比于氧气,还原态的mitoNEET蛋白 [2Fe-2S]铁硫簇在无氧条件下能被ubiquinone-2以3.0× 10 3 M ?1 .s ?1的速率常数快得多的氧化。在有氧条件下,如果存在过量的NADH,mitoNEET蛋白 [2Fe-2S]铁硫簇仍能被还原。但是当NADH消耗完后,被还原的mitoNEET蛋白 [2Fe-2S]铁硫簇会逐渐的被氧气氧化。如果在同样的体系中加入ubiquinone-2后,被还原的mitoNEET蛋白 [2Fe-2S]铁硫簇会被迅速的氧化,如果在更早的时间加入ubiquinone-2, ubiquinone-2会抑制由FMNH2介导的mitoNEET蛋白 [2Fe-2S] 铁硫簇还原。这样的结果表明,在人线粒体中,有氧和无氧条件下,ubiquinone可能是作为还原态的mitoNEET蛋白 [2Fe-2S]铁硫簇在线粒体内的固有的电子受体。
该论文第一作者为2014级硕士研究生李小康,丁焕根教授、吕建新教授为该论文通讯作者。同时美国路易斯安纳州立大学博士生王一鸣、吕建新教授团队谭国强副研究员也参与了部分研究工作。丁焕根教授多年从事铁硫簇组装机制和铁硫蛋白功能的研究工作,在铁硫蛋白的作用机制方面作了大量的研究并取得了显著的成绩。该项研究得到美国国立卫生研究院(项目批准号R15GM109399)、国家自然科学基金海外及港澳学者合作研究基金(项目批准号31629003和81671124)经费的支持。
原文链接: https://www.sciencedirect.com/science/article/pii/S0891584918307470
扫一扫在手机打开当前页